การดื้อยาในมะเร็งระยะแพร่กระจาย
การดื้อยาในมะเร็งระยะแพร่กระจาย
Drug resistance in metastatic cancer
ดร. เกรียงศักดิ์ เลิศประภามงคล และ ศาสตราจารย์เกียรติคุณ ดร. ม.ร.ว. ชิษณุสรร สวัสดิวัตน์
ห้องปฏิบัติการวิจัยชีวเคมี
โรคมะเร็งเป็นโรคที่คร่าชีวิตผู้คนทั่วโลกปีละหลายล้านคน บ่อยครั้งจะพบว่าภายหลังการรักษามะเร็งที่อวัยวะหนึ่งไปแล้ว ไม่ว่าจะเป็นการผ่าตัด ฉายรังสี หรือ เคมีบำบัด อาจพบการกลับเป็นซ้ำ (recurrence) ของมะเร็งในอวัยวะอื่นที่ตรวจไม่พบในครั้งแรก เช่น ผู้ป่วยมะเร็งเต้านมจะตรวจพบการกลับเป็นซ้ำของมะเร็งที่ สมอง ปอด ตับ กระดูก ซึ่งเป็นผลจากการที่เซลล์มะเร็งสามารถเดินทางจากอวัยวะเริ่มต้นไปยังอวัยวะอื่นๆ ที่อยู่ไกลออกไปได้ ปรากฏการณ์นี้เรียกว่า “การแพร่กระจายของมะเร็ง” (เมตาสแตสิส – metastasis) ปัจจุบันนี้ยังไม่มีวิธีการที่มีประสิทธิภาพในการกำจัดมะเร็งที่แพร่กระจายในร่างกาย
เซลล์มะเร็งสามารถจะแพร่กระจายโดยอาศัยระบบไหลเวียนเลือดและน้ำเหลืองของร่างกาย กระบวนการนี้เกิดขึ้นอย่างเป็นขั้นตอน กล่าวคือ เมื่อก้อนมะเร็งมีขนาดใหญ่ขึ้น เซลล์มะเร็งบางส่วนจะรุกราน (invasion) เข้าสู่บริเวณเนื้อเยื่อโดยรอบและแทรกตัวเข้าสู่หลอดเลือดหรือหลอดน้ำเหลืองบริเวณใกล้เคียง เซลล์มะเร็งจะเดินทางลอยไปกับกระแสการไหลเวียนเลือด แล้วไปเกาะติดในอวัยวะที่เป็นทางผ่าน จากนั้นแทรกตัวออกจากหลอดเลือดเพื่อเข้าสู่อวัยวะใหม่ แล้วแบ่งตัวเพิ่มจำนวนเป็นมะเร็งก้อนใหม่ (รูปที่ 1)
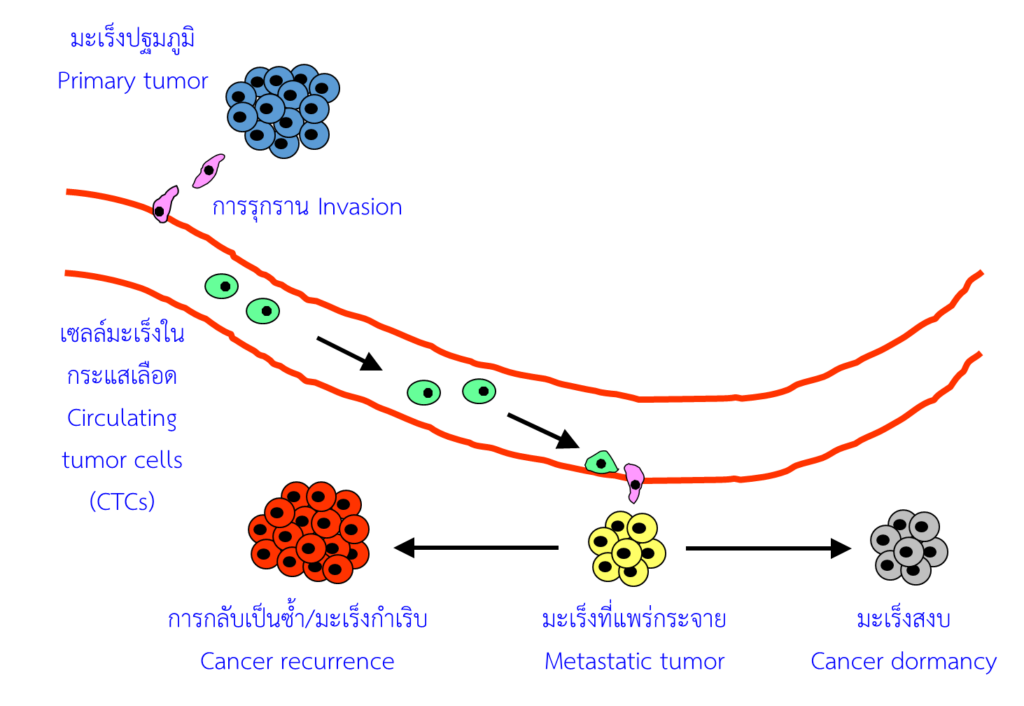 |
รูปที่ 1 กระบวนการแพร่กระจายของมะเร็ง
ผู้ป่วยมะเร็งที่เคยได้รับยาเคมีบำบัดมาก่อน อาจมีการดื้อยาเมื่อตรวจพบการแพร่กระจายของมะเร็ง ซึ่งอธิบายได้ว่า มีเซลล์มะเร็งดื้อยาที่รอดชีวิตอยู่ภายหลังการรักษาด้วยเคมีบำบัดแล้วแพร่กระจายออกไป (รูปที่ 2A) ซึ่งสอดคล้องกับทฤษฎีการคัดเลือกโดยธรรมชาติ (natural selection) ของชาร์ลส์ ดาร์วิน
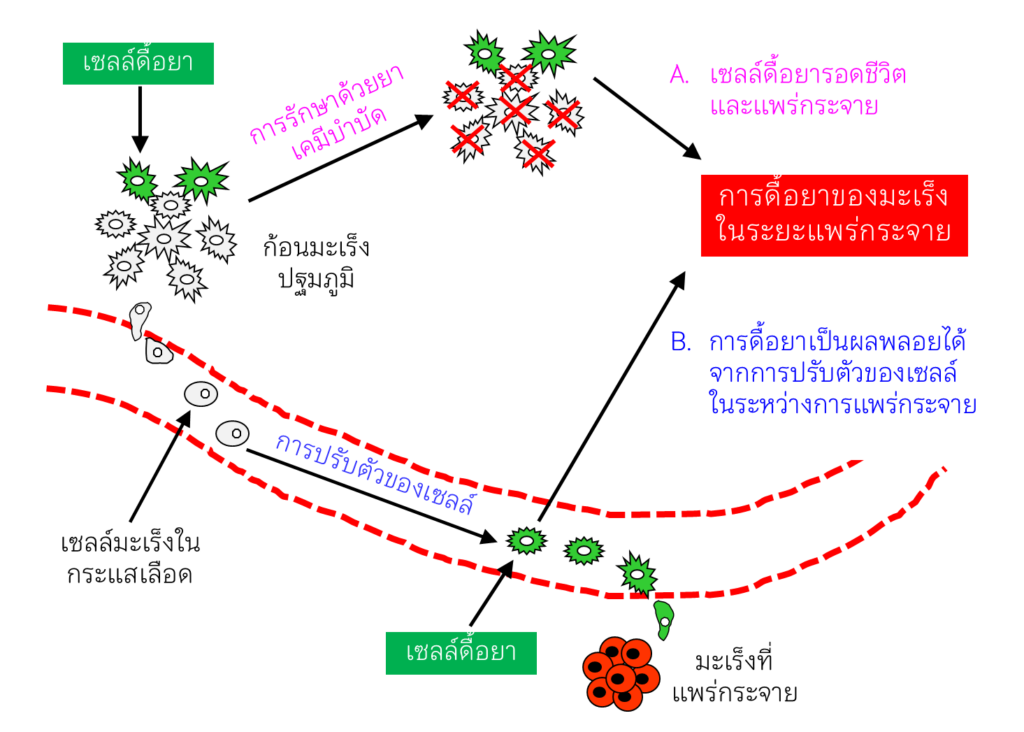 |
รูปที่ 2 การดื้อยาที่เกิดขึ้นในมะเร็งระยะแพร่กระจาย
ทว่าในโรคมะเร็งบางชนิด ผู้ป่วยที่อยู่ในระยะแพร่กระจายอาจตรวจพบการดื้อยา แม้ว่าผู้ป่วยจะไม่เคยได้รับยาเคมีบำบัดมาก่อน (chemo-naïve patients) ดังที่มีรายงานว่า ตรวจพบการดื้อยาแพคลิแทกเซล (paclitaxel หรือ Taxolâ) ในอัตราที่สูงถึง 76-79% ของผู้ป่วยมะเร็งปอดชนิด non-small cell lung cancer ระยะที่ 3 และ 4 ที่ไม่เคยได้รับยาเคมีบำบัดมาก่อน (Chang et al., 1993; Murphy et al., 1993) นอกจากนี้ยังมีงานวิจัยที่ตรวจพบการแสดงออกของยีนที่เกี่ยวข้องกับการดื้อยาในเซลล์มะเร็งที่แยกได้จากเลือด (circulating tumor cells) ของผู้ป่วยมะเร็งเต้านม และในเซลล์มะเร็งจากต่อมน้ำเหลือง (lymph node metastatic cells) ของผู้ป่วยมะเร็งปอด (Gradilone et al., 2011; Triller et al., 2006)
นักวิจัยของห้องปฏิบัติการวิจัยชีวเคมี สถาบันวิจัยจุฬาภรณ์ ได้ตั้งสมมติฐานว่า “การปรับตัวในระหว่างการแพร่กระจายทำให้เซลล์มะเร็งเกิดการดื้อยาขึ้นได้” (รูปที่ 2B) และได้ทำการทดลองเลี้ยงเซลล์มะเร็งปอดชนิด non-small cell lung cancer ในสภาวะที่เลียนแบบเซลล์มะเร็งที่ลอย (floating cells) ในระบบไหลเวียนเลือดและน้ำเหลือง เมื่อนำเซลล์ลอยดังกล่าวมาทดสอบกับยาเคมีบำบัดชนิดต่างๆ พบว่าเซลล์ลอยมีการดื้อต่อยา paclitaxel เพิ่มขึ้นถึง 15.6 เท่า และที่สำคัญเป็นการดื้อยาที่เกิดขึ้นหลังจากเลี้ยงเซลล์ในสภาวะดังกล่าวเพียง 24 ชั่วโมง (Atjanasuppat et al., 2015)
ยา paclitaxel นั้นมีเป้าหมายจับกับโปรตีนเบต้า-ทิวบูลิน (β-tubulin) ภายในเซลล์ นักวิจัยได้ค้นพบกลไกของการดื้อยา paclitaxel ในเซลล์ลอยดังกล่าวว่า โดยพบว่าวิถีสัญญาณ ERK ภายในเซลล์ลอยถูกกระตุ้นการทำงานมากขึ้น ทำให้เซลล์ลอยมีการแสดงออกของยีน β-tubulin ชนิดที่ทนต่อยา paclitaxel (βIVa-tubulin isotype) เพิ่มขึ้นถึง 3 เท่าภายในเวลา 24 ชั่วโมง อันเป็นผลพลอยได้จากการปรับตัวของเซลล์มะเร็งเมื่ออยู่ในสภาวะเซลล์ลอยโดยที่เซลล์ไม่เคยได้สัมผัสกับยามาก่อน (รูปที่ 3)
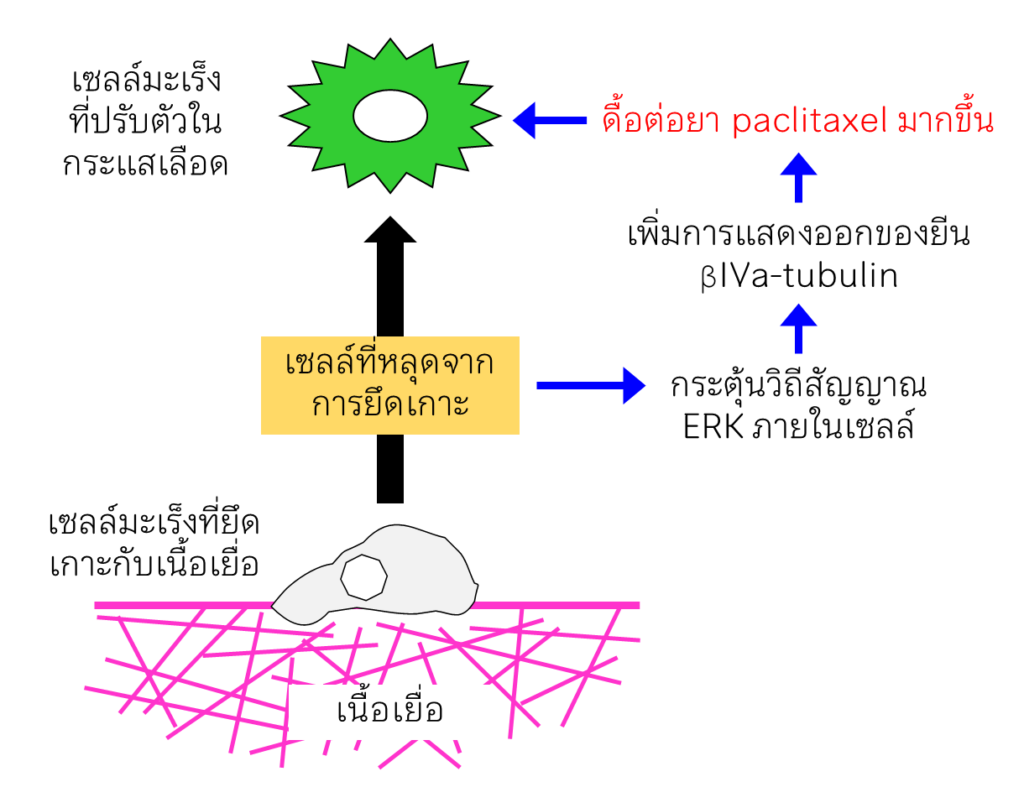 |
รูปที่ 3 กลไกการดื้อยาที่เกิดขึ้นจากการปรับตัวของเซลล์มะเร็งเมื่ออยู่ในสภาวะเซลล์ลอย
การศึกษากลไกของการดื้อยาที่เกิดขึ้นในผู้ป่วยมะเร็งระยะแพร่กระจาย เป็นสิ่งจำเป็นสำหรับการเพิ่มประสิทธิภาพการรักษามะเร็งด้วยวิธีเคมีบำบัด เพราะจะทำให้ทราบล่วงหน้าได้ว่าจะเกิดการดื้อต่อยาประเภทใด และจะป้องกันการดื้อยาดังกล่าวได้อย่างไร ซึ่งจะช่วยลดการกลับเป็นซ้ำของโรคและเพิ่มโอกาสในการรักษาผู้ป่วยโรคมะเร็งให้หายได้
เอกสารอ้างอิง
Atjanasuppat, K., Lirdprapamongkol, K., Jantaree, P., Svasti, J., 2015. Non-adherent culture induces paclitaxel resistance in H460 lung cancer cells via ERK-mediated up-regulation of betaIVa-tubulin. Biochem Biophys Res Commun 466, 493-498.
Chang, A.Y., Kim, K., Glick, J., Anderson, T., Karp, D., Johnson, D., 1993. Phase II study of taxol, merbarone, and piroxantrone in stage IV non-small-cell lung cancer: The Eastern Cooperative Oncology Group Results. J Natl Cancer Inst 85, 388-394.
Gradilone, A., Naso, G., Raimondi, C., Cortesi, E., Gandini, O., Vincenzi, B., Saltarelli, R., Chiapparino, E., Spremberg, F., Cristofanilli, M., Frati, L., Agliano, A.M., Gazzaniga, P., 2011. Circulating tumor cells (CTCs) in metastatic breast cancer (MBC): prognosis, drug resistance and phenotypic characterization. Ann Oncol 22, 86-92.
Murphy, W.K., Fossella, F.V., Winn, R.J., Shin, D.M., Hynes, H.E., Gross, H.M., Davilla, E., Leimert, J., Dhingra, H., Raber, M.N., et al., 1993. Phase II study of taxol in patients with untreated advanced non-small-cell lung cancer. J Natl Cancer Inst 85, 384-388.
Triller, N., Korosec, P., Kern, I., Kosnik, M., Debeljak, A., 2006. Multidrug resistance in small cell lung cancer: expression of P-glycoprotein, multidrug resistance protein 1 and lung resistance protein in chemo-naive patients and in relapsed disease. Lung Cancer 54, 235-240.








