สมุนไพรฟ้าทะลายโจรกับโรคนิปาห์ไวรัส: ศักยภาพทางวิทยาศาสตร์และข้อจำกัดเชิงการแพทย์
ดร.สุทธิพงษ์ ชูจันทร์, รศ.ดร.ภญ.จุฑามาศ สัตยวิวัฒน์
ห้องปฏิบัติการวิจัยเภสัชวิทยา สถาบันวิจัยจุฬาภรณ์
ไวรัสนิปาห์ (Nipah virus) เป็นไวรัสในสกุล Henipavirus วงศ์ Paramyxoviridae ติดต่อจากสัตว์สู่คน ซึ่งมีค้างคาวผลไม้เป็นแหล่งรังโรคหลัก หรืออาจจะพบได้ในสุกร สุนัข แมว ม้า หรือแพะ โดยการสัมผัสใกล้ชิดกับค้างคาวหรือสัตว์ติดเชื้อ ผ่านทางสารคัดหลั่ง น้ำลาย มูล และเสมหะของสัตว์ที่ติดเชื้อ การติดเชื้อไวรัสนิปาห์ในคนจะมีลักษณะคล้ายไข้หวัดใหญ่ คือ มีไข้สูง เจ็บคอ ไอ ปวดเมื่อยตามตัว และอ่อนเพลีย หลังจากรับเชื้อ 4-14 วัน หรืออาจจะก่อให้เกิดอาการรุนแรงทั้งทางระบบทางเดินหายใจและระบบประสาทส่วนกลาง เช่น สมองอักเสบหรือปอดอักเสบเฉียบพลัน ซึ่งนำไปสู่อัตราการเสียชีวิตที่สูงถึงร้อยละ 40-75
โรคติดเชื้อไวรัสนิปาห์ จัดเป็นโรคอุบัติใหม่จากสัตว์สู่คนที่สร้างความกังวลต่อระบบสาธารณสุขทั่วโลกรวมถึงประเทศไทย เนื่องจากการติดเชื้อมีอัตราการเสียชีวิตสูง ในประเทศไทยพบว่า มีเชื้อไวรัสนิปาห์ในค้างคาว แต่ไม่พบว่ามีการระบาดสู่สัตว์เลี้ยงลูกด้วยน้ำนมและมนุษย์ ดังนั้นการควบคุมโรคจึงมุ่งเน้นไปที่การป้องกัน การเฝ้าระวัง และการจัดการผู้ป่วยตามหลักการแพทย์แผนปัจจุบันเป็นหลัก ปัจจุบันยังไม่มีวัคซีนป้องกันและยาที่ใช้รักษาได้อย่างจำเพาะ จึงยังคงเป็นการรักษาแบบประคับประคองอาการ
ในปัจจุบันภายใต้สถานการณ์ดังกล่าว ความสนใจต่อสมุนไพรและสารจากธรรมชาติในฐานะแหล่งของสารออกฤทธิ์ทางชีวภาพจึงเพิ่มมากขึ้น โดยจากการติดตามบทความวิจัยพบว่า มีสมุนไพรหลายชนิดที่มีฤทธิ์เสริมสร้างภูมิคุ้มกันและบรรเทาอาการจากการติดเชื้อไวรัสนิปาห์ เช่น กระชายขาว ขมิ้นชัน ฟ้าทะลายโจร และพืชสมุนไพรชนิดอื่นๆ เป็นต้น
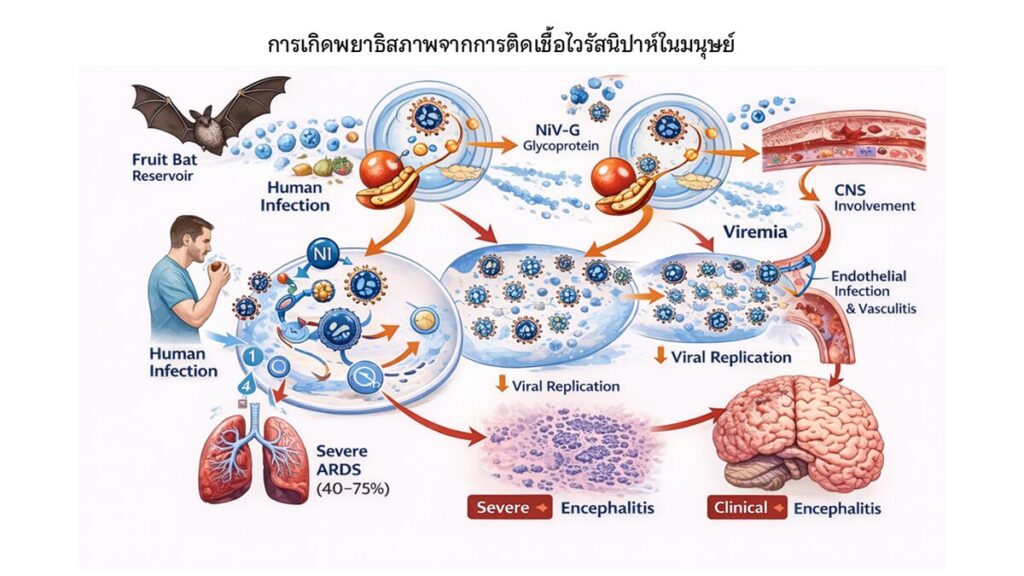
ภาพที่ 1 กลไกการเกิดโรคจากการติดเชื้อไวรัสนิปาห์ในมนุษย์ (Pathogenesis of Nipah Virus Infection in Humans)
ภาพนี้แสดงลำดับขั้นของการติดเชื้อและการดำเนินโรคของไวรัสนิปาห์ (Nipah virus; NiV) ในมนุษย์ โดยไวรัสนิปาห์ มีค้างคาวกินผลไม้ (สกุล Pteropus) เป็นแหล่งรังโรคตามธรรมชาติ การติดต่อสู่มนุษย์สามารถเกิดขึ้นได้จากการสัมผัสโดยตรงกับค้างคาวหรือสารคัดหลั่ง การบริโภคอาหารหรือผลไม้ที่ปนเปื้อน โดยหลังจากไวรัสเข้าสู่ร่างกาย ไวรัสนิปาห์จะจับกับเซลล์เจ้าบ้านผ่านโปรตีน G (NiV-G glycoprotein) ซึ่งจับกับตัวรับ ephrin-B2 และ ephrin-B3 ที่พบได้บนเซลล์เยื่อบุทางเดินหายใจเซลล์บุผนังหลอดเลือด และเซลล์ประสาท จากนั้นโปรตีน F ของไวรัสจะทำหน้าที่ช่วยให้เกิดการหลอมรวมของเยื่อหุ้ม ทำให้ไวรัสสามารถเข้าสู่เซลล์และเริ่มกระบวนการเพิ่มจำนวนของไวรัส (viral replication) ภายในเซลล์บริเวณไซโทพลาสซึม ไวรัสที่เพิ่มจำนวนแล้วจะแพร่กระจายเข้าสู่กระแสเลือด (viremia) ส่งผลให้เกิดการติดเชื้อในเซลล์บุผนังหลอดเลือดทั่วร่างกาย ก่อให้เกิดภาวะหลอดเลือดอักเสบ (vasculitis) ความเสียหายของผนังหลอดเลือด และการเพิ่มความสามารถในการรั่วของหลอดเลือด กระบวนการดังกล่าวนำไปสู่การทำลายกำแพงกั้นระหว่างเลือดกับสมอง (blood–brain barrier; BBB) ทำให้ไวรัสสามารถเข้าสู่ระบบประสาทส่วนกลาง และก่อให้เกิดสมองอักเสบรุนแรง (encephalitis) ขณะเดียวกันการติดเชื้อในระบบทางเดินหายใจและหลอดเลือดปอดส่งผลให้เกิดการบาดเจ็บของเนื้อเยื่อปอดและภาวะหายใจล้มเหลวเฉียบพลัน (acute respiratory distress syndrome; ARDS) การดำเนินโรคที่รุนแรงร่วมกับการอักเสบและความผิดปกติของระบบหลอดเลือด เป็นสาเหตุสำคัญที่ทำให้โรคติดเชื้อไวรัสนิปาห์มีอัตราการเสียชีวิตสูงประมาณร้อยละ 40–75
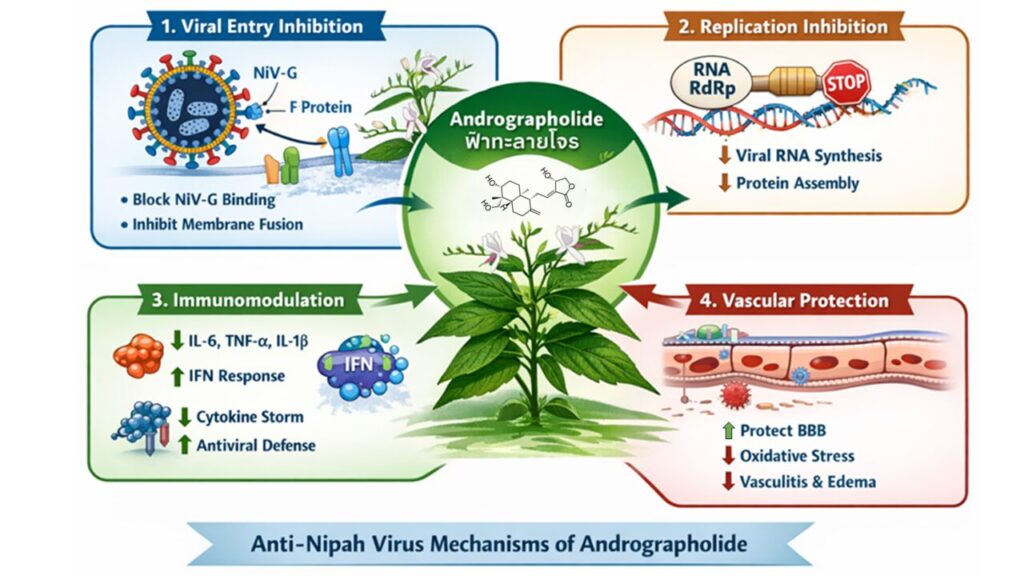
ภาพที่ 2 กลไกที่เป็นไปได้ของสารแอนโดรกราโฟไลด์ (andrographolide) ซึ่งมีอยู่ในสมุนไพรฟ้าทะลายโจรที่สามารถยับยั้งและลดอาการของการติดเชื้อไวรัสนิปาห์โดยผ่านกลไกที่เป็นไปได้ดังนี้ 1. การยับยั้งไวรัสเข้าเซลล์ผ่านการจับโปรตีนบนผิวเซลล์ 2. การรบกวนการทำงานของเอนไซม์ที่ใช้ในการเพิ่มจำนวนไวรัส 3. ลดการหลั่งสารกระตุ้นการอักเสบและกระตุ้นกลไกการป้องกันไวรัสนิปาห์ 4. การป้องกันไวรัสผ่าน blood brain barrier และ ลด oxidative stress ซึ่งช่วยลดอาการสมองอักเสบและหลอดเลือดอักเสบ
ฟ้าทะลายโจร หรือ Andrographis paniculata (Burm. f.) Nees (วงศ์ Acanthaceae) เป็นสมุนไพรสำคัญในแพทย์แผนไทยและเอเชียตะวันออกเฉียงใต้ มีสารออกฤทธิ์หลักคือ แอนโดรกราโฟไลด์ ซึ่งได้รับการศึกษากว้างขวางด้านฤทธิ์ต้านไวรัส ต้านการอักเสบ และกระตุ้นภูมิคุ้มกัน จากการศึกษาทดลองที่ดำเนินการโดยคอมพิวเตอร์ (in silico) พบว่า สารแอนโดรกราโฟไลด์ มีศักยภาพเชิงกลไกในการยับยั้งไวรัสนิปาห์ทั้งทางตรงและทางอ้อม ผ่านการรบกวนการเข้าสู่เซลล์ไวรัส (viral entry) โดยแทรกตัวเข้าบริเวณ receptor-binding domain (RBD-like protein) หรือ glycoprotein interface และลด binding affinity ของโปรตีนไวรัสกับตัวรับ ephrin-B2 และ ephrin-B3 บนผิวเซลล์เจ้าบ้าน ส่งผลให้ลดจำนวนไวรัส (viral load) รวมถึงลดประสิทธิภาพของกระบวนการหลอมรวมของเยื่อหุ้มระหว่างไวรัสกับเซลล์ ทำให้ไวรัสไม่สามารถปล่อยสารพันธุกรรมเข้าสู่ภายในเซลล์ได้อย่างสมบูรณ์ และ แอนโดรกราโฟไลด์ อาจยับยั้งการเพิ่มจำนวนของไวรัส โดยรบกวนการทำงานของเอนไซม์ RNA-dependent RNA polymerase (RdRp) ส่งผลให้การสังเคราะห์สารพันธุกรรมของไวรัสและการสร้างโปรตีนโครงสร้างลดลง จึงทำให้การประกอบอนุภาคไวรัสใหม่ไม่มีประสิทธิภาพ
นอกจากนี้จากการศึกษาฤทธิ์ของสารแอนโดรกราโฟไลด์ ยังพบว่า มีความสามารถในการควบคุมการอักเสบของเซลล์เจ้าบ้าน (host cell) โดยลดการอักเสบผ่านทางโปรตีน NF-κB, MAPK, IL-6, TNF-α และ IL-1β ซึ่งทำให้สามารถลดอาการไข้ ปรับสมดุลการตอบสนองของระบบภูมิคุ้มกันของเซลล์เจ้าบ้าน และยับยั้งการกระตุ้นสัญญาณ NF-κB และ MAPK pathways ซึ่งนำไปสู่การลดการหลั่งสารกระตุ้นการอักเสบ เช่น IL-6, TNF-α และ IL-1β พร้อมทั้งช่วยฟื้นฟูการทำงานของ interferon signaling ที่มีบทบาทสำคัญในการต้านไวรัส ตลอดจนอาจลดความเสี่ยงต่อการเกิดการอักเสบในสมอง ปอด และการอักเสบเชิงระบบ (cytokine storm) ซึ่งศักยภาพของสารแอนโดรกราโฟไลด์ในฟ้าทะลายโจรยังสามารถใช้ได้ในโรคที่เกิดจากการติดเชื้อไวรัสชนิดอื่นๆ ด้วย เช่น ไข้หวัดใหญ่ โควิด-19 รวมถึงไข้หวัดตามฤดูกาล ซึ่งสมุนไพรฟ้าทะลายโจรทำงานในลักษณะของสารต้านไวรัสแบบหลายเป้าหมาย (multi-target antiviral agent) ที่ผสานการยับยั้งไวรัสโดยตรงร่วมกับการควบคุมการอักเสบและการปกป้องอวัยวะสำคัญของร่างกาย
สมุนไพรและสารจากพืชสมุนไพรเป็นแหล่งของสารออกฤทธิ์ทางชีวภาพ (phytochemicals) ที่หลากหลาย งานวิจัยจำนวนมากรายงานว่า สารเหล่านี้มีฤทธิ์ต้านไวรัส ต้านการอักเสบ และต้านอนุมูลอิสระ ซึ่งอาจช่วยลดความรุนแรงของการติดเชื้อหรือการอักเสบที่เกิดขึ้นในร่างกายได้ ในช่วงเวลาที่ผ่านมา มีการนำเทคนิคที่ทำในห้องปฏิบัติการทดลอง (in vitro) และการวิเคราะห์ทดลองทางคอมพิวเตอร์ (in silico) มาใช้คัดกรองสารจากสมุนไพรเพื่อประเมินความสามารถในการยับยั้งโปรตีนหรือกระบวนการสำคัญของไวรัส อย่างไรก็ตาม หลักฐานเหล่านี้ยังอยู่ในระยะเริ่มต้นและไม่สามารถสรุปเชิงการรักษาได้ การนำเสนอข้อมูลเกี่ยวกับสมุนไพรจำเป็นต้องอยู่บนพื้นฐานของหลักฐานทางวิทยาศาสตร์และไม่ก่อให้เกิดความเข้าใจผิด ซึ่งประเด็นที่สำคัญคือ การใช้ขนาดยาที่เหมาะสมกับโรคและระยะเวลาของการใช้สมุนไพร เช่น ฟ้าทะลายโจร จำเป็นต้องมีการศึกษาและวิเคราะห์ข้อมูลเพิ่มเติม แต่ในกรณีภาวะฉุกเฉิน อาจจะใช้ขนาดยาของฟ้าทะลายโจร โดยเทียบเคียงกับขนาดที่ใช้ในโรคโควิด-19 ไปพลางก่อนได้
บทความนี้ มีวัตถุประสงค์เพื่อทบทวนองค์ความรู้เกี่ยวกับศักยภาพของสมุนไพรบางชนิดที่มีรายงานความเป็นไปได้ของฤทธิ์ต้านไวรัส ต้านการอักเสบ หรือเสริมภูมิคุ้มกัน ซึ่งอาจมีความเกี่ยวข้องเชิงทฤษฎีกับการติดเชื้อไวรัสนิปาห์ พร้อมทั้งอภิปรายข้อจำกัดและทิศทางการวิจัยในอนาคต ในเชิงทฤษฎี สารจากสมุนไพรอาจมีบทบาทผ่านกลไกต่างๆ ได้แก่ การรบกวนการเกาะของไวรัสกับเซลล์เจ้าบ้าน การยับยั้งเอนไซม์หรือโปรตีนที่เกี่ยวข้องกับการเพิ่มจำนวนของไวรัส และการลดการอักเสบจากการติดเชื้อ ซึ่งเป็นปัจจัยสำคัญของความรุนแรงของโรค และ กลไกเหล่านี้ยังต้องการการพิสูจน์ในระบบชีวภาพที่ซับซ้อนมากขึ้น อย่างไรก็ตามการป้องกัน การเฝ้าระวัง และการรักษาตามแนวทางการแพทย์แผนปัจจุบันยังคงเป็นหัวใจสำคัญ ในอนาคตการศึกษาต่อยอดพืชสมุนไพรในการต้านไวรัสในระดับโมเลกุล สัตว์ทดลอง และการทดลองทางคลินิก จะมีบทบาทสำคัญในการประเมินศักยภาพที่แท้จริงของสมุนไพรในบริบทของโรคอุบัติใหม่นี้
ที่มา: https://eht.sc.mahidol.ac.th/article/3597
เอกสารอ้างอิง
Hidalgo, M. A., Romero, A., Figueroa, J., Cortés, P., Concha, I. I., & Hancke, J. L. (2005). Andrographolide interferes with binding of nuclear factor-κB to DNA in HL-60-derived neutrophilic cells. British Journal of Pharmacology, 144(5), 680–686. https://doi.org/10.1038/sj.bjp.0706104
Negrete, O. A., Levroney, E. L., Aguilar, H. C., Bertolotti-Ciarlet, A., Nazarian, R., Tajyar, S., & Lee, B. (2005). EphrinB2 is the entry receptor for Nipah virus, an emergent deadly paramyxovirus. Nature, 436(7049), 401–405. https://doi.org/10.1038/nature03838
Lee, B., & Ataman, Z. A. (2011). Modes of paramyxovirus fusion: A Henipavirus perspective. Trends in Microbiology, 19(8), 389–399. https://doi.org/10.1016/j.tim.2011.05.005
Rockx, B., Brining, D., Kramer, J., Callison, J., Ebihara, H., Mansfield, K., & Feldmann, H. (2011). Clinical outcome of Henipavirus infection in hamsters is determined by the route and dose of infection. Journal of Virology, 85(15), 7658–7671. https://doi.org/10.1128/JVI.00473-11
Clayton, B. A., Middleton, D., Bergfeld, J., Haining, J., Arkinstall, R., Wang, L., & Marsh, G. A. (2012). Transmission routes for Nipah virus from Malaysia and Bangladesh. Emerging Infectious Diseases, 18(12), 1983–1993. https://doi.org/10.3201/eid1812.120875
Mathieu, C., Guillaume, V., Volchkova, V. A., Pohl, C., Jacquot, F., Looi, R. Y., Wong, K. T., Legras-Lachuer, C., Volchkov, V. E., Lachuer, J., & Horvat, B. (2012). Nonstructural Nipah virus C protein regulates both the early host proinflammatory response and viral virulence. Journal of Virology, 86(19), 10766–10775. https://doi.org/10.1128/JVI.01203-12
Escaffre, O., Borisevich, V., & Rockx, B. (2013). Pathogenesis of Hendra and Nipah virus infection in humans. Journal of Infectious Diseases, 209(Suppl 2), S122–S130. https://doi.org/10.1093/infdis/jit463
Ang, B. S. P., Lim, T. C. C., & Wang, L. (2018). Nipah virus infection. Journal of Clinical Microbiology, 56(6), e01875-17. https://doi.org/10.1128/JCM.01875-17
Adiguna, S. P., Wijaya, Y. T., Rahmi, E. P., & Kurniawan, F. (2021). Antiviral activities of andrographolide and its derivatives: Mechanism of action and potential application. Viruses, 13(11), 2209. https://doi.org/10.3390/v13112209
DeBuysscher, B. L., Scott, D., Thomas, T., Feldmann, H., & Prescott, J. (2021). Nipah virus efficiently replicates in human smooth muscle cells. Cells, 10(6), 1319. https://doi.org/10.3390/cells10061319
Cai, Q., Lin, Y., Shi, S., & Huang, Y. (2022). Andrographolide: A review of its pharmacology, mechanisms of action, and therapeutic potential. Frontiers in Pharmacology, 13, 920435. https://doi.org/10.3389/fphar.2022.920435
Devnath, P., Uddin, M. H., Hossain, M. E., & Chakraborty, A. (2022). Pathogenesis of Nipah virus infection: A review. Microbial Pathogenesis, 170, 105687. https://doi.org/10.1016/j.micpath.2022.105687
Mandal, M., & Mandal, S. (2024). Discovery of multitarget-directed small molecule inhibitors from Andrographis paniculata for Nipah virus disease therapy: Molecular docking, molecular dynamics simulation and ADME-Tox profiling. Chemical Physics Impact, 8, 100493. https://doi.org/10.1016/j.chphi.2024.100493
Malarvizhi, G. L., & Bayry, J. (2025). Rationally designed functionalized phytochemical-conjugated fullerene quantum dots inhibiting viral chaperone activity and RNA-dependent RNA polymerase in Nipah virus. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 39(15), e70890. https://doi.org/10.1096/fj.202501100R
Ren, Z., Chen, Z., Xie, Y., & Coghi, P. (2025). Andrographolide and its derivatives: A comprehensive review of anti-infective properties and clinical potential. Molecules, 30(21), 4273. https://doi.org/10.3390/molecules30214273